Foto: Agência Brasil
 |
Brasília
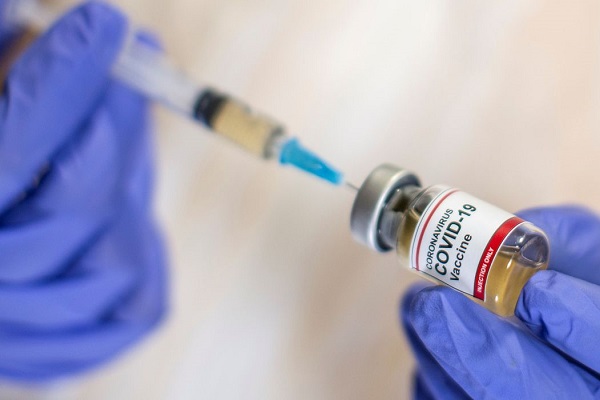
A Agência Nacional de Vigilância Sanitária (Anvisa) definiu os procedimentos de submissão contínua de dados técnicos para o registro de vacinas contra a covid-19. A Instrução Normativa nº 77/2020 foi aprovada ontem (17) pela diretoria colegiada do órgão e publicada hoje (18) no Diário Oficial da União.

Segundo a Anvisa, os diretores também dispensaram a análise de impacto regulatório e consulta pública para o registro devido ao grau de urgência da vacina e gravidade da doença.
“A medida possibilitará acelerar a disponibilização à população brasileira de vacinas contra o novo coronavírus, desde que demonstradas qualidade, segurança e eficácia conforme os requerimentos técnicos e regulatórios vigentes”, informou a agência, em comunicado.
No procedimento de submissão contínua, os dados técnicos deverão ser encaminhados à Anvisa conforme forem gerados. Assim, as empresas interessadas no registro de vacinas não precisam ter em mãos todos os documentos reunidos para apresentá-los ao órgão regulador.
Submissão contínua
Esse procedimento será normatizado apenas para as vacinas contra covid-19 a serem registradas no país. Segundo a Anvisa, outras autoridades regulatórias de referência, como a dos Estados Unidos, da Europa, da Suíça e da China, já utilizam a submissão contínua em situações específicas.
A proposta da Anvisa prevê o atendimento a dois critérios para uso desse procedimento diferenciado. Um deles se refere à exigência de um dossiê de desenvolvimento clínico de medicamento referente à vacina proposta, protocolado na agência. Outro critério é que a pesquisa esteja em fase 3 de desenvolvimento clínico.
As vacinas que tiverem a análise iniciada pelo procedimento de submissão contínua poderão ser submetidas ao pedido de registro formal após a conclusão da análise do último aditamento protocolado.
Além disso, a empresa deve ter dados suficientes de qualidade, eficácia e segurança para o estabelecimento de uma relação positiva de benefício e risco da vacina, considerando a indicação terapêutica solicitada à Anvisa.
A instrução normativa publicada hoje regulamenta artigo da Resolução nº 55/2010 da Anvisa, que diz que a empresa solicitante do registro poderá procurar a Coordenação de Produtos Biológicos para discutir aspectos relacionados ao desenvolvimento do produto, antes da submissão da documentação de registro.
Fonte: Agência Brasil